Производные 3-карбоксипропил-аминотетралина и родственные соединения в качестве антагонистов mu-опиоидного рецептора
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы (I) или их фармацевтически приемлемым солям, имеющим антагонистическую активность в отношении mu-опиоидного рецептора. В формуле (I) R1 обозначает -ORa или -С(О)NRbRc; R2, R3 и R4 обозначают, каждый независимо, C1-3алкил; R5 выбран из С1-6алкила, циклогексила, -(СН2)1-3-циклогексила и -(СН2)1-3-фенила; Ra, Rb и Rc обозначают, каждый независимо, водород; и R6 обозначает водород или С1-3алкил; и заместители в хиральных центрах, отмеченных звездочками, находятся в конфигурации транс. Изобретение относится также к способу получения соединений формулы (I), к промежуточным соединениям, используемым в синтезе соединений формулы (I) и способу их получения. Кроме того, изобретение относится к фармацевтической композиции, включающей соединения формулы (I), и применению таких соединений для лечения заболеваний или состояний, связанных с активностью mu-опиоидного рецептора. 9 н. и 16 з.п. ф-лы, 19 пр.
Реферат
УРОВЕНЬ ТЕХНИКИ
Область изобретения
Изобретение относится к соединениям 3-карбоксипропил-аминотетралина, которые могут быть использованы в качестве антагонистов mu-опиоидного рецептора. Изобретение также относится к фармацевтическим композициям, включающим такие соединения, к способам применения таких соединений для лечения или облегчения медицинских состояний, опосредуемых активностью mu-опиоидного рецептора, и к способам и промежуточным соединениям, которые могут быть использованы для получения таких соединений.
Уровень техники
Теперь стало в целом понятно, что эндогенные опиоиды играют сложную роль в физиологии желудочно-кишечного тракта. Рецепторы опиоидов экспрессируются в организме повсеместно, как в центральной нервной системе, так и в периферических областях, включая желудочно-кишечный тракт (ЖКТ).
Соединения, которые функционируют как агонисты опиоидных рецепторов, примером-прототипом которых является морфин, являются основами анальгетической терапии для лечения боли, имеющей интенсивность от умеренной до тяжелой. К сожалению, использование аналгезирующих опиоидных средств часто сочетается с неблагоприятными эффектами в отношении ЖКТ, в целом называемыми индуцированной опиоидами дисфункцией кишечника (OBD). OBD включает такие симптомы, как запор, сниженное опорожнение желудка, боль и дискомфорт в животе, вздутие, тошнота и гастроэзофагеальный рефлюкс. Как центральные, так и периферические опиоидные рецепторы вероятно участвуют в замедлении гастроинтестинального транзита после применения опиоида. Однако ряд данных свидетельствует, что периферические опиоидные рецепторы в ЖКТ прежде всего ответственны за неблагоприятные эффекты опиоидов на функционирование ЖКТ.
Так как побочные эффекты опиоидов преимущественно опосредуются периферическими рецепторами, тогда как аналгезия является центральной по происхождению, периферический селективный антагонист может потенциально блокировать нежелательные гастроинтестинальные побочные эффекты, не препятствуя полезным центральным эффектам аналгезии или ослабляя синдром отмены на уровне центральной нервной системы.
Из трех главных подтипов опиоидного рецептора, обозначаемых как mu, delta и kappa, большинство клинически используемых опиоидных анальгетиков оказывают анальгетическое действие и изменяют моторику ЖКТ предположительно через активацию mu-опиоидного рецептора. Соответственно, периферические селективные антагонисты mu-опиоида, как ожидают, будут пригодны для лечения вызываемой опиоидами дисфункции кишечника. Предпочтительные средства будут демонстрировать значительное связывание на mu-опиоидных рецепторах in vitro и будут активны in vivo в гастроинтестинальных моделях животных.
Послеоперационная непроходимость кишечника (POI) представляет собой нарушение, связанное со сниженной моторикой ЖКТ, которое встречается после брюшной или другой хирургии. Симптомы POI подобны таковым OBD. Кроме того, так как пациенты хирургии в течение и после хирургической операции часто получают лечение опиоидными анальгетиками, продолжительность POI может сопровождаться снижением моторики ЖКТ, связанной с использованием опиоидов. Поэтому также ожидается, что антагонисты mu-опиоидов, пригодные для лечения OBD, будут также пригодны для лечения POI.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к новым соединениям, которые обладают активностью антагонистов mu-опиоидного рецептора, и к промежуточным соединениям для их получения.
Соответственно, изобретение относится к соединению формулы (I):
в которой
R1 обозначает -ORa или -C(O)NRbRc;
R2, R3 и R4 обозначают, каждый независимо, C1-3алкил;
R5 выбран из C1-6алкила, фенила, циклогексила, -(CH2)1-3-циклогексила и
-(CH2)1-3-фенила;
Ra, Rb и Rc обозначают, каждый независимо, водород или C1-3алкил; и
R6 обозначает водород или C1-3алкил; и
в которой заместители в хиральных центрах, отмеченных звездочками, находятся в конфигурации транс;
или к его фармацевтически приемлемой соли.
Изобретение также относится к фармацевтической композиции, включающей соединение по изобретению и фармацевтически приемлемый носитель.
Изобретение также относится к способу лечения заболевания или состояния, связанного с активностью mu-опиоидного рецептора, например нарушения, связанного со сниженной моторикой желудочно-кишечного тракта, такого как вызванная опиоидом дисфункция кишечника и послеоперационная непроходимость кишечника, включающему введение млекопитающему терапевтически эффективного количества соединения или фармацевтической композиции по изобретению.
Соединения по изобретению могут также использоваться в качестве инструментальных средств для исследования, то есть для изучения биологических систем или проб, или для изучения активности других химических соединений. Соответственно, в другом из аспектов способа изобретение относится к способу применения соединения формулы (I), или его фармацевтически приемлемой соли, в качестве инструмента для исследования в целях изучения биологической системы или пробы, или для обнаружения новых соединений, имеющих активность mu-опиоидного рецептора, включающему введение биологической системы или пробы в контакт с соединением по изобретению и определения эффектов, вызванных соединением на биологической системе или пробе.
В отдельных и различных аспектах изобретение также относится к способам синтеза и к промежуточным соединениям, описанным здесь, которые могут быть использованы для получения соединений по изобретению.
Изобретение также относится к соединению по изобретению, как описано здесь, для применения в медицинской терапии, а также к применению соединения по изобретению в получении состава или лекарственного средства для лечения заболевания или состояния, связанного с активностью mu-опиоидного рецептора, например нарушения, связанного со сниженной моторикой желудочно-кишечного тракта, у млекопитающего.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к 3-карбоксипропил-аминотетралиновым антагонистам mu-опиоидного рецептора формулы (I), к их фармацевтически приемлемым солям и к промежуточным соединениям для их получения. Следующие заместители и значения представляют собой репрезентативные примеры различных аспектов этого изобретения. Эти репрезентативные значения дополнительно определяют такие аспекты и не предназначены для исключения других значений или для ограничения объема изобретения.
В частном аспекте R1 обозначает -ORa или -C(O)NRbRc.
В другом частном аспекте R1 обозначает -OH или -C(O)NH2.
В еще одном частном аспекте R1 обозначает -C(O)NH2.
В частном аспекте R2, R3 и R4 обозначают, каждый независимо, C1-3алкил.
В другом частном аспекте R2 и R3 обозначают, каждый независимо, метил или этил.
В других аспектах R2 и R3 обозначают этил; или R2 и R3 обозначают метил.
В частном аспекте R4 обозначает метил.
В частном аспекте R5 выбран из C1-6алкила, фенила, циклогексила, -(CH2)1-3-циклогексила и -(CH2)1-3-фенила.
В другом частном аспекте R5 выбран из C3-5алкила, циклогексила, -(CH2)1-3-циклогексила и -(CH2)1-3-фенила. Репрезентативные группы представителя R5 в рамках этого аспекта включают, но не ограничены ими, н-пентил, н-бутил, 2,2-диметилпропил, 2-метилпропил, 1-метилэтил, циклогексил, циклогексилметил, 4-фенилбутил и фенилметил.
В еще одном частном аспекте R5 обозначает циклогексилметил.
В частном аспекте R6 обозначает водород или C1-3алкил.
В другом аспекте R6 обозначает водород, то есть соединения представляют собой карбоновые кислоты.
Было показано, что карбоновые кислоты по изобретения являются мощными антагонистами mu-опиоидного рецептора.
В других аспектах R6 обозначает C1-3алкил, или R6 обозначает метил, то есть соединения представляют собой сложные эфиры.
Как описано ниже, сложные эфиры по изобретению являются полезными промежуточными соединениями для получения карбоновых кислот по изобретению. Кроме того, было показано, что сложноэфирные соединения, в которых R1 обозначает -C(O)NH2, R2 и R3 обозначают этил, R4 обозначает метил, R5 обозначает 2-метилпропил или циклогексилметил, и R6 обозначает метил, являются мощными антагонистами mu-опиоидного рецептора.
Изобретение также относится к соединениям из Примеров 1-16.
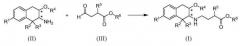
Используемый здесь принцип присвоения химических названий проиллюстрирован для соединения Примера 1
которое представляет собой (S)-4-((2S,3S)-7-карбамоил-1,1-диэтил-3-метокси-1,2,3,4-тетрагидронафталин-2-иламино)-2-(циклогексилметил)масляную кислоту согласно соглашениям IUPAC, используемым в программном обеспечении AutoNom (MDL Information Systems, GmbH, Франкфурт, Германия). Для удобства, бициклическая 1,2,3,4-тетрагидронафталин-2-иламиногруппа альтернативно указана здесь под обычным названием "аминотетралин".
Все соединения по изобретению находятся в конфигурации транс относительно двух хиральных центров, обозначенных звездочками в формуле (I):
В дополнение к стереохимии аминотетралиновой группы, соединения по изобретению могут содержать хиральный центр в атоме углерода, к которому присоединен заместитель R5. Соединения могут быть чистым диастереомером, например (2S),(3S) диастереомер соединения Примера 1, изображенного выше, или смесями (2S),(3S) диастереомера и (2R),(3R) диастереомера. Такие диастереомерные смеси обозначены здесь приставкой транс. Соответственно, изобретение включает чистые диастереомеры, смеси диастереомеров, рацемические смеси и стереоизомерно обогащенные смеси изомеров, если не указано иное. Когда стереохимия соединения определена, специалисту будет понято, что незначительные количества других стереоизомеров могут присутствовать в композициях по изобретению, если не указано иное, при условии, что пригодность композиции в каком-либо качестве в целом не исключается в силу присутствия таких других изомеров.
В другом аспекте изобретение относится к соединению формулы (Ia):
в котором стереохимия в хиральных центрах представляет собой (2S),(3S) и в котором R1, R2, R3, R4, R5 и R6 принимают любое из значений, описанных выше.
В частном аспекте изобретение относится к соединению формулы (Ia), в которой:
R1 обозначает -C(O)NH2;
R2 и R3 обозначают этил;
R4 обозначает метил;
R5 выбран из C3-5алкила, циклогексила, -(CH2)1-3-циклогексила и -(CH2)1-3-фенила; и
R6 обозначает водород или метил;
или к его фармацевтически приемлемой соли.
При введении млекопитающему, медицинские соединения обычно метаболизируются в организме до форм, которые могут быть выделены. Как описано ниже в разделе примеров, метаболическое превращение соединений по изобретению исследовали, инкубируя соединение по изобретению с сохраненными замораживанием человеческими гепатоцитами и сравнивая полученные метаболиты с соединениями известной структуры. Полученные результаты подтверждают заключение, что основной метаболит гидроксила соединения из Примера 1 замещен гидроксилом в положении 4 циклогексильного кольца.
Поэтому в еще одном аспекте изобретение относится к соединению формулы (Ib), в которой R обозначает гидроксил:
причем соединение формулы (Ib), в которой R обозначает гидроксил, получен in vivo путем введения человеку соединения формулы (Ib), в которой R является водородом.
Определения
При описании соединений, композиций и способов по изобретению следующие термины имеют следующие значения, если не указано иное.
Термин "алкил" означает одновалентную насыщенную углеводородную группу, которая может быть прямой или разветвленной или представлять собой комбинации этого. Если не указано иное, такие алкильные группы обычно содержат от 1 до 10 атомов углерода. Репрезентативные алкильные группы включают, например, метил, этил, н-пропил (n-Pr), изопропил (i-Pr), н-бутил (n-Bu), втор-бутил, изобутил, трет-бутил, н-пентил, н-гексил, 2,2-диметилпропил, 2-метилбутил, 3-метилбутил, 2-этилбутил, 2,2-диметилпентил, 2-пропилпентил и т.п.
Термин "соединение" означает соединение, которое было искусственно получено или получено любым другим способом, таким как метаболизм in vivo.
Термин “терапевтически эффективное количество” означает количество, достаточное для лечения эффекта при введении пациенту.
Термин "лечение" в рамках изобретения означает лечение заболевания, нарушения или медицинского состояния у пациента, такого как млекопитающее (особенно человек), которое включает один или более из следующих эффектов:
(a) предотвращение возникновения заболевания, нарушения или медицинского состояния, то есть профилактическое лечение пациента;
(b) облегчение заболевания, нарушения или медицинского состояния, то есть устранение или регрессию заболевания, нарушения или медицинского состояния у пациента, включая противодействие эффектам других терапевтических средств;
(c) подавление заболевания, нарушения или медицинского состояния, то есть замедление или остановку развития заболевания, нарушения или медицинского состояния у пациента; или
(d) облегчение симптомов заболевания, нарушения или медицинского состояния у пациента.
Термин “фармацевтически приемлемая соль” означает соль, полученную из кислоты или основания, которая является приемлемой для введения пациенту, такому как млекопитающее. Такие соли могут быть получены из фармацевтически приемлемых неорганических или органических кислот и из фармацевтически приемлемых оснований. Как правило, фармацевтически приемлемые соли соединений согласно настоящему изобретению получают из кислот.
Соли, полученные из фармацевтически приемлемых кислот, включают, но не ограничены ими, уксусную, адипиновую, бензолсульфоновую, бензойную, камфорсульфоновую, лимонную, этансульфоновую, фумаровую, глюконовую, глутаминовую, гликолевую, бромистоводородную, хлористоводородную, молочную, малеиновую, яблочную, миндальную, метансульфоновую, муциновую, азотную, щавелевую, пантотеновую, фосфорную, янтарную, серную, винную, п-толуолсульфоновую, ксинафоевую (1-гидрокси-2-нафтойную кислоту), нафталин-1,5-дисульфоновую кислоту и т.п.
Термин "защитная группа аминогруппы" означает защитную группу, подходящую для предотвращения нежелательных реакций на азоте аминогруппы. Репрезентативные защитные группы аминогруппы включают, но не ограничены ими, формил; ацильные группы, например алканоильные группы, такие как ацетил и три-фторацетил; алкоксикарбонильные группы, такие как трет-бутоксикарбонил (Вос); арилметоксикарбонильные группы, такие как бензилоксикарбонил (Cbz) и 9-флуоренилметоксикарбонил (Fmoc); арилметильные группы, такие как бензил (Bn), тритил (Tr), и 1,1-ди-(4'-метоксифенил)метил; силильные группы, такие как триметилсилил (TMS) и трет-бутилдиметилсилил (TBDMS); и т.п.
Термин "защитная группа гидрокси-группы" означает защитную группу, подходящую для предотвращения нежелательных реакций в гидроксильной группе. Репрезентативные защитные группы гидрокси-группы включают, но не ограничены ими, алкильные группы, такие как метил, этил и трет-бутил; ацильные группы, например алканоильные группы, такие как ацетил; арилметильные группы, такие как бензил (Bn), п-метоксибензил (PMB), 9-флуоренилметил (Fm) и дифенилметил (бензгидрил, DPM); силильные группы, такие как триметилсилил (TMS) и трет-бутилдиметилсилил (TBS); и т.п.
Общие процедуры синтеза
Соединения по изобретению могут быть получены из легко доступных исходных материалов с использованием следующих общих способов и процедур. Хотя частный аспект настоящего изобретения проиллюстрирован на схемах ниже, специалисту понятно, что все аспекты настоящего изобретения могут быть осуществлены с использованием способов, описанных здесь, или при использовании других способов, реагентов и исходных материалов, известных специалисту. Следует также понимать, что там, где указан типичный или предпочтительный режим процесса (то есть температуры, время реакции, молярные отношения реагентов, растворители, давление и т.д.), другой режим процесса может также использоваться, если не указано иное. Оптимальные условия реакции могут варьировать в зависимости от конкретных используемых реагентов или растворителя, но такие условия могут быть определены специалистом в соответствии с обычными процедурами оптимизации.
Дополнительно, как будет очевидным специалисту, обычные защитные группы могут быть необходимыми для того, чтобы воспрепятствовать некоторым функциональным группам участвовать в нежелательных реакциях. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящих условий для защиты и снятия защиты является известным в данной области техники. Например, многочисленные защитные группы и их введение и удаление описаны в T. W. Greene and G. M. Wuts, Protecting Groups in Organic Synthesis, Third Edition, Wiley, New York, 1999, и в цитируемых там ссылках.
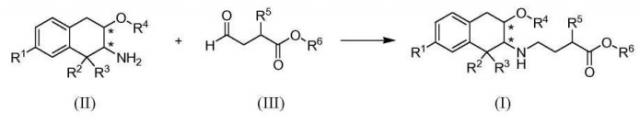
В типичном способе синтеза сложные эфиры по изобретению формулы (I), в которой R6 обозначает C1-3алкил, получали как показано в Схеме A. (Заместители и переменные, показанные на следующих схемах, имеют определения, приведенные выше, если не указано иное).
Схема А
На Схеме A промежуточное соединение (II) восстановительно N-алкилировано реакцией с альдегидом (III) с получением продукта (I). Реакцию обычно проводят, вводя промежуточное соединение (II) в контакт с от приблизительно 1 до приблизительно 2 эквивалентов альдегида формулы (III) в подходящем инертном разбавителе, таком как дихлорметан, метанол или 2-метилтетрагидрофуран, в присутствии от приблизительно 1 до приблизительно 5 эквивалентов восстановителя. Реакцию обычно проводят при температуре в диапазоне от приблизительно 0°C до температуры окружающей среды в течение от приблизительно получаса до приблизительно 3 часов или до в основном полного завершения реакции. Типичные восстановители включают триацетоксиборгидрид натрия, борогидрид натрия и цианоборгидрид натрия.
Альдегид (III) может быть получен in situ из соответствующего бисульфитного аддукта (III'):
реакцией с основанием, таким как гидроксид натрия, непосредственно перед реакцией с аминотетралином (II).
Карбоновые кислоты по изобретению формулы (I), в которой R6 является водородом, получают из вышеуказанных сложных эфиров, вводя соответствующий сложный эфир в контакт с избытком основания, например, от приблизительно 4 до приблизительно 6 эквивалентов основания, такого как гидроксид натрия в метаноле. Реакцию проводят при температуре от приблизительно 25 до приблизительно 50°C в течение времени от приблизительно 2 до приблизительно 24 часов или до в основном полного завершения реакции.
Альтернативно, карбоновая кислота по изобретению может быть получена процессом, в котором в R6 используют защитную группу гидроксигруппы и который включает конечную стадию удаления защитной группы, как описано ниже в Примере 17.
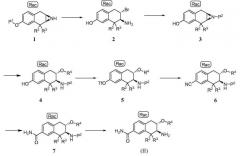
Пример процедуры получения аминотетралинового промежуточного соединения (II), в котором переменная R1 обозначает -C(O)NH2, проиллюстрирован на Схеме B
Схема B
где P1 обозначает защитную группу гидроксигруппы, P2 обозначает защитную группу аминогруппы, и -OTf обозначает трифторметан сульфонат (обычно трифлат). Примечание "Rac" показывает, что соединение представляет собой рацемическую смесь специфической изображенной структуры и структуры, имеющей противоположную стереохимию в хиральных центрах.
Небольшие алкильные группы могут быть использованы в качестве защитных групп P1. При использовании алкила для P1 азиридиновое промежуточное соединение 1 может быть введено в реакцию с HBr с получением промежуточного соединения 2, которое предпочтительно выделяют в твердой форме в форме соли HBr. Обычно промежуточное соединение 1 вводят в контакт с избытком, например от приблизительно 12 до приблизительно 18 эквивалентов, HBr. Эффективность реакции может быть улучшена включением катализатора фазового переноса. Реакцию обычно проводят при температуре от приблизительно 90 до приблизительно 110°C в течение от приблизительно 10 до приблизительно 20 часов или до в основном полного завершения реакции. Используя Вос, например, в качестве защитной группы P2 , промежуточное соединение 3 получают затем, обрабатывая 2 основанием, преобразуя азиридиновое кольцо in situ, добавляя от приблизительно 1 до приблизительно 1,3 эквивалента ди-трет-бутилдикарбоната (обычно (Вос)2O) в обычных условиях реакции, получая промежуточное соединение 3.
Альтернативно, группу P1 азиридинового промежуточного соединения 1 удаляют в две стадии реакцией с HBr или BBr3 и последующей обработкой основанием, чтобы получить промежуточное соединение 2a:
которое затем защищают на азоте азиридина, например реакцией с (Boc)2O, получая промежуточное соединение 3.
Затем амино-защищенный азиридин 3 вводят в контакт с большим избытком спирта R4OH в присутствии умеренного кислотного катализатора, такого как пиридий тозилат, получая промежуточное соединение 4.
Промежуточное аминотетралиновое соединение формулы (II), в которой R1 обозначает -ОН, может быть получено удалением защитной группы от промежуточного соединения 4. Например, когда защитная группа P2 является Вос, промежуточное фенольное соединение формулы (II) получают, обрабатывая соединения 4 кислотой. Точно так же промежуточное аминотетралиновое соединение формулы (II), в которой R1 обозначает -ORa, где Ra обозначает C1-3алкил, может быть получено аналогично исходя из промежуточного соединения формулы (I), в которой P1 является желаемой небольшой алкильной группой, и исключением начальной стадии удаления защитной группы.
Остальные стадии на Схеме B относятся к превращению гидроксизамещенного аминотетралина 4 в карбоксамидзамещенное промежуточное соединение 7 и к конечной стадии удаления защитной группы. Гидроксил промежуточного соединения 4 сначала превращают в трифлат, вводя 4 в контакт в инертном разбавителе с от приблизительно 1 до приблизительно 2 эквивалентов трифторметан сульфонилхлорида в присутствии от приблизительно 1 до приблизительно 3 эквивалентов основания, такого как триэтиламин, получая промежуточное соединение 5. Реакция 5 с цианидом цинка в присутствии катализатора на основе переходного металла приводит к промежуточному соединению 6. Эту реакцию обычно проводят при температуре от приблизительно 80 до 120°C в инертной атмосфере в течение от приблизительно получаса до приблизительно 2 часов или до в основном полного завершения реакции.
Затем нитрил промежуточного соединения 6 гидролизуют до карбоксамида промежуточного соединения 7. Как описано ниже в примерах, в одном способе синтеза нитрил 6 вводят в контакт с от приблизительно 5 до приблизительно 8 эквивалентами моногидрата пербората натрия в инертном разбавителе, таком как метанол. Реакцию проводят при температуре от приблизительно 50 до приблизительно 60°C в течение от приблизительно 12 до приблизительно 24 часов или до в основном полного завершения реакции. Альтернативные способы гидролиза нитрила до амида включают использование платинового катализатора, в частности гидридо(диметилфосфоновая кислота-kP)[водород-бис(диметилфосфинито-kP)]платины (II), и обработку пероксидом водорода, как описано в примерах ниже. Наконец, от промежуточного соединения 7 удаляют защитную группу обычной обработкой кислотой, получая аминотетралин формулы (II).
Промежуточное соединение формулы (II), в которой R1 обозначает -C(O)NRbRc, где Rb и Rc обозначают алкил, может быть получено из промежуточного соединения 6 превращением нитрила в карбоновую кислоту путем гидролиза в присутствии основания с последующим амидным сочетанием с амином формулы HNRbRc.
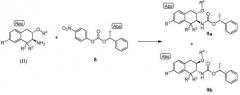
Индивидуальные энантиомеры формулы (II) могут быть разделены с использованием хирального вспомогательного соединения. Схема C иллюстрирует использование хирального вспомогательного соединения, представляющего собой 4-нитро-фенил (R)-1-фенил-этиловый эфир (8):
Схема С
для получения пары нерацемических диастереомеров 9a и 9b, которые могут быть разделены. Примечание "Abs" обозначает определенное показанное хиральное соединение. Рацемический аминотетралин (II) вводят в контакт с от приблизительно 0,8 до приблизительно 1,2 эквивалентов хирального вспомогательного соединения 8 в инертном разбавителе в присутствии от приблизительно 2 до приблизительно 4 эквивалентов основания, такого как триэтиламин, с получением диастереомерной смеси промежуточных соединений 9a и 9b. Реакцию обычно проводят при температуре от приблизительно 80 до приблизительно 95°C в течение от приблизительно 4 до приблизительно 20 часов или до в основном полного завершения реакции. Диастереомеры 9a и 9b могут быть разделены высокоэффективной жидкостной хроматографией (ВЭЖХ) и собраны отдельно или кристаллизацией, в которой диастереомер 9a селективно кристаллизуется, оставляя преимущественно диастереомер 9b в растворе. Наконец, карбаматная группа может быть удалена от выделенных диастереомеров 9a и 9b обработкой кислотой с получением индивидуальных энантиомеров аминотетралина (II). Хиральные вспомогательные соединения 8 могут быть получены реакцией (R)-1-фенилэтанола с п-нитрофенил хлороформиатом, как описано ниже в примерах.
Промежуточное азиридиновое соединение 1, используемое в Схеме B, может быть получено реакцией замещенного 3,4-дигидро-1Н-нафталин-2-он:
с галогеналкилом, чтобы добавить алкильные заместители R2 и R3 в положение 2, обработкой солью гидроксиламина для превращения карбокси в оксим и последующей обработкой литий-алюминийгидридом или другим восстановителем для превращения оксима в азиридин 1, как описано, например, в US 6 844 368 и в Примере получения 14, ниже.
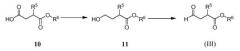
Альдегид (III), используемый в Схеме A, предпочтительно получают из соответствующей карбоновой кислоты 10, как показано на Схеме D:
Схема D
где R6 обозначает C1-3алкил. Восстановление гидрида бора карбоновой кислоты 10 приводит к спирту 11. Реакцию обычно проводят, вводя кислоту 10 в контакт с приблизительно 2 эквивалентами комплекса боран-тетрагидрофуран в тетрагидрофуране при температуре от приблизительно -5 до приблизительно 0°C. Спирт 11 затем окисляют до альдегида (III). Реагенты, которые могут быть использованы для окисления, включают диметилсульфоксид, активированный комплексом пиридин-триоксид серы и кипохлоритом натрия с 2,2,6,6-тетраметилпиперидин-1-оксиловым (TEMPO) катализатором. Если желательно, спирт 11 может быть преобразован в бисульфитный аддукт (III') без выделения альдегида (III) путем добавления бисульфита натрия после стадии окисления.
Дальнейшие детали относительно конкретных условий реакции и других процедур для получения репрезентативных соединений по изобретению или промежуточных соединений для их получения описаны ниже в примерах.
Соответственно, в одном аспекте способа изобретение относится к способу получения соединения формулы (I), или его соли, включающему (a) введение соединения формулы (II) в реакцию с соединением формулы (III), в которой R6 обозначает C1-3алкил, и, (b), когда R6 обозначает водород, вводя продукт стадии (a) в контакт с избытком основания, получая соединение формулы (I) или его соль.
В других аспектах изобретение относится к новому промежуточному соединению формулы 2 или его гидробромиду и к способу получения гидробромида соединения 2 в твердой форме, включающему введение соединения формулы 1 в реакцию с HBr и выделение продукта в твердой форме.
Фармацевтические композиции
Соединения 3-карбоксипропил-аминотетралина по изобретению обычно вводят пациенту в форме фармацевтической композиции или состава. Такие фармацевтические композиции могут вводиться пациенту любым приемлемым путем введения, включая, но не ограничиваясь ими, пероральный, ректальный, влагалищный, носовой, путем ингаляции, топический (включая чрескожный) и парентеральный способы введения.
Соответственно, в одном из аспектов композиций изобретение относится к фармацевтической композиции, включающей фармацевтически приемлемый носитель или эксципиент и терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли. В случае необходимости, такие фармацевтические композиции могут содержать, если желательно, другие терапевтические средства и/или средства для получения состава. Применительно к композициям, "соединение по изобретению" может также быть указанно как "активный агент". В рамках изобретения термин "соединение по изобретению" включает соединения формулы (I), а также варианты, воплощенные в формуле (Ia). "Соединение по изобретению" включает, кроме того, фармацевтически приемлемые соли и сольваты соединения, если не указано иное.
Фармацевтические композиции по изобретению обычно содержат терапевтически эффективное количество соединения согласно настоящему изобретению или его фармацевтически приемлемой соли. Специалисту понятно, однако, что фармацевтическая композиция может содержать больше, чем терапевтически эффективное количество, то есть композиции внавес, или меньше, чем терапевтически эффективное количество, то есть индивидуальные унифицированные дозы, предназначенные для многократного введения для достижения терапевтически эффективного количества.
Как правило, такие фармацевтические композиции содержат от приблизительно 0,1 до приблизительно 95 вес.% активного агента; предпочтительно, от приблизительно 5 до приблизительно 70 вес.%; и более предпочтительно от приблизительно 10 до приблизительно 60 вес.% активного агента.
Любой обычный носитель или эксципиент может использоваться в фармацевтических композициях по изобретению. Выбор конкретного носителя или эксципиента, или комбинаций носителей или эксципиентов, будет зависеть от способа введения, используемого для лечения конкретного пациента, или от типа медицинского состояния или болезненного состояния. В этом отношении, получение подходящей фармацевтической композиции для конкретного способа введения находится в рамках квалификации специалиста. Дополнительно, носители или эксципиенты, используемые в фармацевтических композициях по изобретению, являются коммерчески доступными. В качестве дальнейшей иллюстрации, обычные методики получения составов описаны в Remington: The Science and Practice of Pharmacy, 20th Edition, Lippincott Williams & White, Baltimore, Maryland (2000); и H.C. Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th Edition, Lippincott Williams & White, Baltimore, Maryland (1999).
Репрезентативные примеры материалов, которые могут служить фармацевтически приемлемыми носителями, включают, но не ограничены ими, следующее: сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза, такие как микрокристаллическая целлюлоза и ее производные, такие как натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза и ацетилцеллюлоза; порошковый трагакант; солод; желатин; тальк; эксципиенты, такие как в форме масла какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; многоатомные спирты, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар-агар; буферные средства, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический солевой раствор; раствор Рингера; этиловый спирт; фосфатные буферные растворы; и другие нетоксичные совместимые вещества, используемые в фармацевтических композициях.
Фармацевтические композиции обычно получают, тщательно и тесно смешивая или перемешивая активный агент с фармацевтически приемлемым носителем и одним или более дополнительными ингредиентами. Полученная однородно смешанная смесь может затем быть составлена или заполнена в таблетки, капсулы, пилюли и т.п. с использованием обычных процедур и оборудования.
Фармацевтические композиции по изобретению предпочтительно упаковывают в форме лекарственных форм. Термин "стандартная лекарственная форма" относится к физически дискретной единице, подходящей для введения пациенту, то есть каждая единица содержит предварительно определенное количество активного агента, вычисленное таким образом, чтобы оно производило желаемый терапевтический эффект, индивидуально или в комбинации с одной или более дополнительными единицами. Например, такие стандартные лекарственные формы могут быть капсулами, таблетками, пилюлями и т.п., или упаковками форм, подходящих для парентерального введения.
В одном варианте осуществления фармацевтические композиции по изобретению являются подходящими для перорального введения. Подходящие фармацевтические композиции для перорального введения могут быть в форме капсул, таблеток, пилюль, таблеток для рассасывания, облаток, драже, порошков, гранул; или в форме раствора или суспензии в водной или неводной жидкости; или в форме жидкой эмульсии масло-в-воде или вода-в-масле; или в форме эликсира или сиропа; и т.п.; при этом каждая такая форма содержит предварительно определенное количество соединения согласно настоящему изобретению в качестве активного ингредиента.
Когда фармацевтические композиции по изобретению предназначены для перорального введения в твердой лекарственной форме (то есть в форме капсул, таблеток, пилюль и т.п.), они обычно включают активный агент и один или более фармацевтически приемлемых носителей, таких как цитрат натрия или дикальций фосфат. В случае необходимости или альтернативно, такие твердые лекарственные формы могут также включать: наполнители или экстендеры, такие как крахмалы, микрокристаллическая целлюлоза, лактоза, сахароза, глюкоза, маннит и/или кремневая кислота; связующие, такие как карбоксиметилцеллюлоза, альгинаты, желатин, поливинил пирролидон, сахароза и/или гуммиарабик; увлажнители, такие как глицерин; дезинтеграторы, такие как агар-агар, карбонат кальция, картофельный крахмал или крахмал тапиоки, альгиновую кислоту, некоторые силикаты и/или карбонат натрия; ингибиторы растворения, такие как парафин; ускорители абсорбции, такие как четвертичные аммониевые основания; смачивающие вещества, такие как цетиловый спирт и/или моностеарат глицерина; абсорбирующие вещества, такие как каолин и/или бентонитовая глина; лубриканты, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, и/или их смеси; красители; и буферные средства.
Агенты, способствующие высвобождению, смачивающие вещества, средства для создания покрытий, подсластители, вкусовые агенты и отдушки, консерванты и антиоксиданты могут также присутствовать в фармацевтических композициях по изобретению. Примеры фармацевтически приемлемых антиоксидантов включают: водорастворимые антиоксиданты, такие как аскорбиновая кислота, цистеин гидрохлорид, бисульфат натрия, метабисульфат натрия, сульфит натрия и т.п.; маслорастворимые антиоксиданты, такие